REAZIONI COMPLETE
Una reazione chimica tra due reagenti A e B è una reazione completa quando alla fine del processo non vi è più traccia dei reagenti, che si sono completamente trasformati nei prodotti C e D.
Una reazione di questo tipo è rappresentata da una sola freccia
A + B → C + D
Per indicare che la trasformazione è avvenuta in maniera completa.
REAZIONI REVERSIBILI
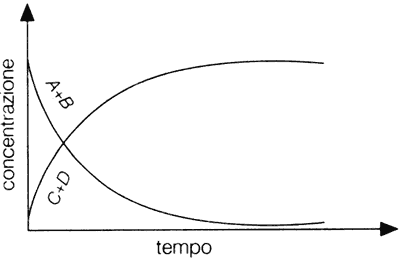
Una reazione reversibile è una reazione che può avvenire anche nel verso opposto, cioè i prodotti ottenuti reagiscono tra loro per ridare i reagenti. Quindi questa reazione sarà rappresentata da due frecce di verso opposto.

L’equilibrio chimico e dinamico ed il suo raggiungimento non significa che la reazione di formazione dei prodotti si sia fermata.in realtà il sistema si evolve continuamente anche se non mostra nel tempo variazioni delle concentrazioni delle specie coinvolte.accade cioè che i prodotti si trasformano nei reagenti in modo tale da rimpiazzare esattamente le quantità di questi che reagiscono. Ovvero la velocità della reazione diretta (reagenti —> prodotti) è uguale a quella inversa (prodotti —> reagenti).
LA COSTANTE DI EQUILIBRIO
Nell’equilibrio chimico, se la temperatura non cambia, esiste un rapporto costante tra la concentrazione dei prodotti e quella dei reagenti, ognuna elevata a un esponente corrispondente al proprio coefficiente stechiometrico. La relazione che permette di calcolare il valore della costante di equilibrio è espressa in una legge nota come:

VALORI DELLA COSTANTE DI EQUILIBRIO
Il valore numerico della costante di equilibrio Keq ci dà informazioni sulla tendenza che ha una reazione ad avvenire a una certa temperatura:
Valori elevati di Keq indicano che la reazione è fortemente spostata verso i prodotti, essendo i prodotti al numeratore.
Valori molto bassi di Keq ci dicono che l’equilibrio è spostato verso i reagenti, in quanto si avranno concentrazioni dei prodotti basse ed elevate concentrazioni dei reagenti.
PRINCIPIO DI LE CHATELIER
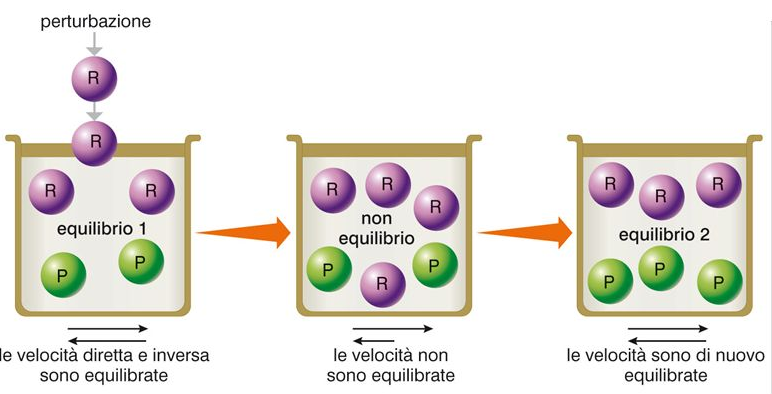
Se si interviene su una reazione all’equilibrio, tale reazione, dopo un certo tempo, raggiunge un nuovo stato di equilibrio. Ovvero, data una reazione all’equilibrio ad una certa temperatura, è possibile spostare l’equilibrio in un senso nell’altro senza che il valore della costante cambi, modificando alcuni parametri. Gli spostamenti possono essere descritti utilizzando il cosiddetto principio dell’equilibrio mobile o di Le Chatelier.
MODIFICA DELLE CONCENTRAZIONI
Se all’equilibrio incrementiamo le concentrazioni dei reagenti, si realizza un nuovo equilibrio più spostato a destra verso i prodotti rispetto al precedente. Se invece di aumentano le concentrazioni dei prodotti, si realizza un nuovo equilibrio più spostato a sinistra, verso i reagenti.
MODIFICA DELLA TEMPERATURA
Al variare della temperatura varia il valore della costante di equilibrio.
Nelle REAZIONI ESOTERMICHE, se si incrementa la T, la K diminuisce, quindi l’equilibrio si sposta più a sinistra.

Nelle REAZIONI ENDOTERMICHE se si incrementa la T, la K aumenta, quindi l’equilibrio si sposta più a destra.
